Kimia adalah salah satu subjek yang wajib dipilih oleh murid atau siswa dari Sekolah Menengah Atas (SMA) di tahun 2020 ini sebagai mapel Ujian Nasional baik itu Ujian Nasional Berbasis Komputer (UNBK) maupun Ujian Nasional Berbasis Alat Tulis (UNKP) sehingga mempelajarinya menjadi suatu keharusan dan kewajiban.
Untuk mendapatkann nilai yang bagus maka diperlukan beberapa kemampuan seperti intuisi dan kemampuan berhitung yang baik mengenai zat atau materi, inti atom, semua hal yang berkaitan dalam mata pelajaran kimia secara keseluruhan termasuk menghitung pH (tingkat hidrogen) suatu larutan buffer, asam, dan basa.
Hal ini yang kemungkinan menyebabkan mata pelajaran kimia sebagai salah satu yang tersulit yang diujiankan dalam suatu ujian berstandardisasi nasional yaitu Ujian Nasional, tidak heran juga banyak siswa yang mengeluh karena kesusahan untuk mendapatkan nilai sempurna atau seratus bahkan mendapatkan nilai B pun tergolong sulit minta ampun.
Baca juga: Bumi Setengah Jam Lebih Cepat di Zaman Dinosaurus
Namun jangan takut, karena pada hari ini sainsologi.com akan membagiakn suatu latihan soal yang dilengkapi dengan pembahasan agar siswa-siswa sekalian dapat mempelajari secara komprehensif dan mendetil agar meraih suatu mimpi dan cita-cita bangsa bagi kawula muda, menjadi yang terbaik di angkatan dengan nilai kimia SMA 2020.
Tapi suatu hal yang didapatkan misalnya nilai sempurna adalah bagaikan keajaiban karena seperti yang kita ketahui bahwa permainan intuisi, logika, dan pikiran benar-benar dipertaruhkan, oleh karena itu saya menyarankan untuk mencoba latihan lain dan memilih mata pelajaran yang di-UNkan yaitu Fisika ataupun Biologi karena lebih mudah.
Kimia yang menghitung suatu larutan, zat, sangat berkaitan erat dengan Fisika seperti dalam pelajaran bab Fisika Inti dan Modern yang mempelajari model atom, mempelajari suatu gerak kuantum, dan menghitung relativitas, namun tidak serta merta membuat soal-soal kimia yang diajarkan dan dites menjadi mudah, karena tes kimia harus admin akui sangatlah sulit.
Apalagi dengan suatu kebijakan baru Kementrian Pendidikan dan Kebudayaan (Kemendikbud) yang sekarang menaungi Perguruan Tinggi Negeri (PTN) dan menghapuskan Ujian Nasional pada tahun 2021 dengan Ujian Berbasis Karakter (UBK) yang akan meningkatkan kompetensi dalam dunia kehidupan demi kemajuan bangsa. Tak hanya itu, Kemendikbud juga mengeluarkan surat edaran yang berisikan bahwa tiap-tiap sekolah di SMA tahun 2020 akan dihapuskan USBN (Ujian Sekolah Berstandar Nasional) dan diganti dengan USP (Ujian Satuan Pendidikan).
USP atau Ujian Satuan Pendidikan berbeda-beda namanya dalam tiap provinsi seperti misalnya Surabaya dan daerah jawa timur lainnya menetapkan USP-BKS sebagai namanya, namun yang jelas USP ini sama saja dengan USBN hanya beda nama saja dan soalnya dibuat tidak dalam taraf nasional melainkan oleh Pemerintah Daerah ataupun dari sekolah masing-masing.
USP Kimia yang akan dibagikan kalin ini akan terdiversifikasi menjadi beberapa bagian terkonsentrasi demi mencapai suatu nilai pendidikan tinggi dan estetika dalam membuat siswa-siswa yang ada di Indonesia menjadi pintar, cerdas, dan genius (jenius adalah kata tidak baku, lesson learned). Kebanyakan soal didapat dari soal Ujian Nasional (UN) tahun-tahun sebelumnya seperti tahun ajaran 2015/2016, tahun 2017, digabung dengan pembahasan yang detil.
Baca juga: Virus Corona Dalam Gambar, Bagaimana Virus Ini Mengubah Dunia
Dalam mengerjakan soal kimia, tips terpenting adalah mengerjakannya dengan tenang agar kemudian mendapatkan suatu pencapaian jiwa, ketenangan hati, membuat dapat fokus dalam waktu 2 jam atau waktu yang telah ditentukan. Ketika sudah lelah dalam mengerjakan misal 15 soal diperlukan untuk beristirahat beberapa menit agar otak kembali fresh dan siap ditempa lagi menjadi yang terbaik.
Soal yang terbilang cukup ribet dan sulit tetap saja diujiankan dan mengetes banyak siswa-siswa yang memilih kimia, namun dalam USP, hal ini menjadi hal yang lain karena pasalnya semua siswa wajib mengikuti ujian kimia, untungnya admin sudah mengerjakannya dan mendapatkan nilai 82.5 alhamdulillah dari sekitar 40 soal, terima kasih juga kepada beberapa website yang ada di Google.
Tapi bukan berarti saya searching, karena saya menemukan beberapa blog yang membagikan secara tulus soal-soal tahun sebelumnya untukkemudian dipelajari secara repetitif, hal ini tentu saja membantu kami sebagai murid yang diwajibkan mengikuti ujian online atau daring subjek Kimia di tahun 2020 ini.
Oleh karena itulah, demenshare.com akan membagikan soal-soal kimia tersebut karena telah membantu banyak orang, dibagikan ulang dengan beberapa penambahan yang lebih bai dan soal yang berkualitas tinggi agar kamu semua pembaca blog ini mendapatkan nilai yang bagus dalam kimia.
Untuk latihan soal ini, admin mendapatkannya dari banyak pihak, terima kasih kepada Pak Sukardan yang telah mengizinkan saya belajar kimia, dan sesuai namanya yaitu demenshare, akan dishare kembali di sini untuk poin-poin terpenting.
Baca juga: Fenomena Brain Drain di Negara-Negara Berkembang
Mengenai Ujian Nasional Berbasis Komputer (UNBK) di tahun 2020, karena maraknya penyebaran covid-19 (coronavirus disease 2019), besar kemungkinan Ujian Nasional tetap dijalankan namun prosedurnya sedikit diubah, seperti misalnya di Provinsi Banten, surat edaran telah dikeluarkan dan mengumumkan akan mengundur Ujian Nasional sampai tenggat tanggal waktu yang telah ditentukan.
Jadi, tidak mungkin apabila Ujian Nasional tahun 2020 dihapuskan mengingat bahwa pembuat soal dari tim kemendikbud sudah bersusah payah dalam membuat soal yang berkualitas tinggi kepada khalayak siswa kawula muda di Indonesia. Memang ada petisi yang menyarankan untuk menghapus Ujian Nasional dengan alasan membawa tekanan kepada siswa, saya rasa hal itu tidak benar karena Ujian Nasional menjadi golden ticket untuk para pejuang beasiswa mendapatkan nilai yang terbaik dan berkuliah di luar negeri.
Universitas yang menawarkan program studi jurusan kimia memang banyak di dunia ini, dan Indonesia mempunyai salah satu yang terbaik yaitu terletak di Institut Teknologi Bandung (ITB), namun itu tadi dalam UNBK 2020, Kimia, Fisika, dan Biologi dipertaruhkan bagi para pejuang beasiswa berkuliah di universitas prestisius luar negeri untuk masyarakat Indonesia yang mengglobal.
Soal UNBK USP Ujian Sekolah SMA Kimia 2020
Berikut ini dia yang telah admin rangkum, Latihan Soal UNBK USP SMA Mapel Kimia Tahun 2020 dari website tanya-tanya.com dan ruangguru.com.
Baca juga:
Soal no. 1-20
1) Diketahui unsur X dan Z memiliki konfigurasi elektron sebagai berikut:
X:[Ar] 4s1 3d6
Z:[Ne] 3s2 3p5
Apabila X dan Z bersenyawa, rumus senyawa yang terbentuk adalah
A. X3Z
B. X3Z2
C. X2Z
D. X2Z3
E. XZ3
PEMBAHASAN :
Tentukan kecenderungan membentuk konfigrasi stabil
X:[Ar] 4s1 3d6
(bisa melepas 2 e) membentuk X2+
(bisa melepas 3e) membentuk X3+
Z:[Ne] 3s2 3p5 (menangkap 1 e) membentuk Z–
Jika keduanya berikatan maka akan melakukan ikatan ion (terjadi antara yang
melepaskan e (ion +) dengan yang menangkap e (ion -) membentu senyawa XZ2 atau
XZ3. Mekanismenya seperti berikut:
X2+ + Z- (muatan X (2) menjadi jumlah atom Z, muatan Z (1) menjadi jumlah
atom Z, sehingga menjadi XZ2)
X3+ + Z- (muatan X (3) menjadi jumlah atom Z, muatan Z (1) menjadi jumlah
atom Z, sehingga menjadi XZ3)
JAWABAN E
Soal No.2
Berikut tabel data beberapa unsur dengan nomor atomnya
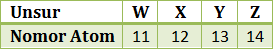
Grafik yang menunjukkan kecenderungan energi ionisasi dari unsur-unsur
tersebut.
A) 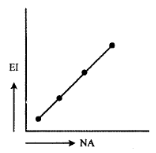
B) 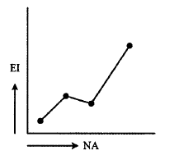
C) 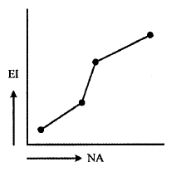
D) 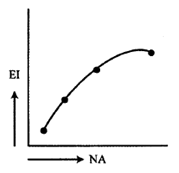
E) 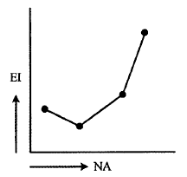
PEMBAHASAN :
Di periode ketiga terdapat penyimpangan energi ionisasi (idealnya semakin besar
nomor atom semakin besar energi ionisasi). Penyimpangan ini berupa naiknya
tanya-tanya.com
energi ionisasi Mg, Hal ini dijelaskan dari konfigurasinya
Konfigurasi elektron yang penuh lebih stabil sehingga sulit untuk melepaskan
elektron sehingga diperlukan energi yang besar artinya Energi ionisasi Mg lebih
tinggi dibanding Al. Sehingga grafiknya:
JAWABAN B
Soal No.3
Diberikan tabel sifat 2 buah zat sebagai berikut:

Keterangan: (+) = konduktor ; (—) = non konduktor
Berdasarkan data tersebut, dapat disimpulkan bahwa .. ..
A. Zat M : Senyawa kovalen non polar, Zat N : Senyawa Ionik
B. Zat M : Senyawa kovalen non polar, Zat N : Senyawa kovalen polar
C. Zat M : Senyawa kovalen non polar, Zat N : Logam
D. Zat M : Senyawa kovalen polar, Zat N : Logam
E. Zat M : Senyawa kovalen polar, Zat N : Senyawa Ionik
PEMBAHASAN :
Perbedaan senyawa ion, kovalen polar dan non polar di jelaskan tabel berikut tanya-tanya.com
Maka dari data tabel M merupakan senyawa non polar karena titik leleh rendah dan
tidak larut dalam air. Sedangkan N merupakan senyawa ionik karena larut dalam air
dan lelehannya dapat menghantar listrik
JAWABAN A
Soal No.4
Harga keempat bilangan kuantum untuk elektron terakhir dari atom 17Cl adalah….
A. n = 3; l=0; m = -1; s = + 1⁄2
B. n = 3; l=0; m = +1; s = – 1⁄2
C. n = 3; l=1; m = +1; s = + 1⁄2
D. n = 3; l=2; m = 0; s = – 1⁄2
E. n = 3; l=1; m = 0; s = – 1⁄2
PEMBAHASAN :

JAWABAN E
Soal No.5
Suatu larutan asam klorida bereaksi dengan logam seng menghasilkan larutan seng
klorida dan gas hidrogen. Persamaan reaksi setara untuk pernyataan tersebut
adalah….
A. Zn(s) + HCl(aq) → ZnCl(aq) + H(g)
B. Zn(s) + HCl(aq) → ZnCl2(aq) + H2(g)
C. Zn(s) + 2HCl(aq) → ZnCl2(aq) + H(g) tanya-tanya.com
D. Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
E. Zn(s) + 2HCl(aq) → ZnCl(aq) + H2(g)
PEMBAHASAN :
Logam seng : Zn(s)
Larutan asam klorida : HCl (aq)
Larutan seng klorida : Zn2+ + Cl- → ZnCl2 (aq)
Gas hidrogen : H2 (g), maka reaksinya
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g) (setelah disetarakan)
JAWABAN D
Soal No.6
Suatu senyawa karbon terdiri dari 40% massa C, 6,7% massa H dan sisanya
oksigen. Rumus molekul senyawa tersebut (Ar: C =12, H = 1, dan O =16) dan Mr
senyawa 60 adalah….
A. CH2O
B. C2H4O2
C. C2H2O
D. C2H4O
E. C2H4O4
PEMBAHASAN :

JAWABAN B
Soal No.7
Magnesium dapat bereaksi dengan oksigen membentuk magnesium oksida
dengan perbandingan massa sebagai berikut:
Berdasarkan data tersebut, perbandingan massa Mg dengan O dalam senyawa
tersebut adalah….
A. 4 : 3
B. 3 : 4
C. 3 : 2
D. 2 : 3
E. 2 : 1
PEMBAHASAN :
Untuk menentukan perbandingan massa Mg dan O dengan cara mudah yaitu dengan
menjumlahkan massa Mg dan O dan jumlahnya tersebut harus sama dengan massa
MgO. Untuk percobaan 4, penjumlahan massa Mg dan O sama dengan massa MgO,
maka perbandingannya bisa ditentukan dari perbandingan massa Mg dan massa O
(Perc 4) Massa Mg : Massa O = 24 : 16 = 3: 2
JAWABAN C
Baca juga: Orang Terkaya di Dunia Sepanjang Sejarah Berasal dari Afrika
Soal No.8
Berikut ini beberapa contoh penerapan sifat koloid dalam kehidupan sehari-hari:
(1) proses pembersihan darah dalam ginjal
(2) sorot lampu dalam gedung bioskop
(3) pembentukan delta di muara sungai
(4) pembentukan karang oleh binatang
(5) pembuatan ban kendaraan dari karet alam
Peristiwa dialisis dan efek Tyndall dapat ditemukan pada contoh nomor….
A. (1) dan (2)
B. (2) dan (3)
C. (3) dan (4)
D. (4) dan (5)
E. (5) dan (2)
PEMBAHASAN :
(1) proses pembersihan darah dalam ginjal merupakan contoh dari dialisis yaitu
penyaringan ion-ion pengganggu melalui selaput semipermeabel
(2) pembentukan delta di muara sungai merupakan contoh dari koagulasi yaitu
proses penggumpalan dari sistem koloid karena adanya ion lain yang berbeda
muatan
(3) pembuatan ban kendaraan dari karet alam merupakan contoh dari koagulasi
yaitu proses penggumpalan dari sistem koloid karena adanya ion lain yang berbeda
muatan
(4) pembentukan karang oleh binatang merupakan contoh dari koagulasi yaitu
proses penggumpalan dari sistem koloid karena adanya ion lain yang berbeda
muatan.
JAWABAN A
Soal No.9
Berikut ini beberapa contoh penerapan sifat koligatif dalam kehidupan sehari-hari:
(1) desalinasi air laut
(2) penggunaan etilen glikol pada radiator mobil
(3) cairan infus yang dimasukkan ke dalam darah
(4) proses merambatnya air pada akar tanaman
(5) penggunaan garam pada pembuatan es puter
Contoh penerapan sifat koligatif yang merupakan proses penurunan titik beku
adalah nomor….
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (5)
E. (3) dan (4)
PEMBAHASAN :
(1) desalinasi air laut merupakan proses reversible osmosis,berkaitan dengan sifat
koligatif tekanan osmosis yaitu tekanan yang diperlukan untuk menghentikan proses
osmosis
(2) penggunaan etilen glikol pada radiator mobil merupakan penerapan penurunan
titik beku. Etilen glikol ditambahkan agar menurunkan titik beku air
(3) cairan infus yang dimasukkan ke dalam darah berkaitan dengan proses osmosis
(4) proses merambatnya air pada akar tanaman berkaitan dengan proses osmosis
(5) penggunaan garam pada pembuatan es puter berfungsi untuk menurunkan titik
beku air untuk mendinginkan es puter
JAWABAN D
Soal No.10
Data titrasi 20 mL HNO3 0,1 M dengan larutan Ca(OH)2 adalah sebagai berikut:
Massa Ca(OH)2 (Mr = 74) yang bereaksi adalah…. tanya-tanya.com
A. 0,074 gram
B. 0,148 gram
C. 0,232 gram
D. 0,288 gram
E. 0,370 gram
PEMBAHASAN :
Gunakan rumus titrasi
a. Ma. Va = b. Mb. Vb
1.0,1M. 20 = 2. nbasa
n = 1 mmol
Gr = n x Mr = 1 x 74 = 74 mgram = 0,074 gram
JAWABAN A
Soal No.11
Perhatikan senyawa/ion berikut:
(1) NH4
+
(2) NH3
(3) CO3
2-
(4) HCO3
–
(5) H2CO3
Senyawa/ion yang berfungsi sebagai penyangga pada cairan luar sel adalah….
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (3) dan (4)
E. (4) dan (5)
PEMBAHASAN :
Senyawa/ion yang berfungsi sebagai penyangga pada cairan luar sel adalah
H2CO3 dan HCO3
– sedangkan senyawa/ion yang berfungsi sebagai penyangga
intra/di dalam sel adalah H2PO 4- dan HPO4 2-
JAWABAN E
Soal No.12
Sebanyak 7,4 gram Ca(OH)2 dilarutkan dalam 250 mL air. Harga pH larutan yang
terjadi sebesar .. . .(Ar Ca = 40, O = 16, H= 1)
A. 1- log8
B. 1-1og 4
C. 1-log 2
D. 13 + log 2
E. 13 + log 8
PEMBAHASAN :

JAWABAN B
Soal No.13
Sebanyak 100 mL CaCl2 0,6 M dicampur dengan 100 mL Na2CO3 0,6 M. Jika Ksp
CaCO3 = 2,8 x 10-9, massa zat yang mengendap sebesar (Ar Ca = 40; C = 12; O = 16;
Na= 23; Cl = 35,5)….
A. 6 gram
B. 9 gram
C. 60 gram
D. 100 gram
E. 120 gram
PEMBAHASAN :

JAWABAN A
Soal No.14
Garam amonium klorida NH4Cl dapat dibuat dengan mereaksikan 50 mL larutan
NH3 0,2 M dan 50 mL larutan HCI 0,2 M, menurut reaksi: NH3(aq) + HCl(aq) →
NH4Cl(aq). Senyawa tersebut dalam air mengalami hidrolisis dengan pH larutan
sebesar…. (Kb NH3 = 10-5; Kw= 10-14)
A. 1 – log 5
B. 1 + log 5
C. 5 + log 1
D. 9 + log 1
E. 9 + log 5
PEMBAHASAN :

JAWABAN C
Baca juga: Mengapa Bisa Terdapat Banyak Bahasa di Dunia
Soal No.15
Perhatikan beberapa larutan berikut!
(1) HNO3 2M (3) NH40H 2 M
(2) H2SO4 2 M (4) C6H2O6 2 M
Pasangan larutan yang diperkirakan memiliki daya hantar listrik sama kuat
adalah nomor….
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan(4)
E. (3) dan (4)
PEMBAHASAN :
Elektrolit Kuat terdiri dari asam kuat, basa kuat dan garam
Elektrolit lemah terdiri dari asam lemah, basa lemah
Non elektrolit : Glukosa, urea , alkohol
HNO3 (asam kuat) : elektrolit kuat
H2SO4 (asam kuat) : elektrolit kuat
NH4OH (basa lemah) : elektrolit lemah
C6H12O6 : non elektrolit
JAWABAN A
Soal No.16
Suatu bahan makanan diuji dengan :
1. pereaksi biuret terbentuk warna ungu
2. pereaksi timbal (II) asetat terbentuk warna hitam
Berdasarkan hasil uji tersebut dapat disimpulkan dapat disimpulkan bahwa bahan
makanan tersebut mengandung….
A. Zat : Protein, Jenis Kandungan : Sistein
B. Zat : Protein, Jenis Kandungan : Tirosin
C. Zat : Karbohidrat, Jenis Kandungan : Amilum
D. Zat : Protein, Jenis Kandungan : Glisin
E. Zat : Karbohidrat, Jenis Kandungan : Glukosa
PEMBAHASAN :
Pereaksi biuret akan membentuk warna ungu jika dimasukkan ke dalam zat yang
mengandung protein. Sedangkan, peraksi timbal akan membentuk warna hitam jika
dimasukan ke dalam asam amino yang mengandung unsur belerang (s). Asam amino
yang mengandung unsur belerang yaitu sistein
JAWABAN A
Soal No.17
Beberapa kegunaan bahan makanan:
(1) biokatalis
(2) mengatur metabolisme lemak
(3) membentuk struktur sel jaringan
(4) memperbaiki sel yang rusak dan
(5) cadangan energi
Pasangan kegunaan bahan makanan yang mengandung karbohidrat adalah….
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (3) dan (4)
E. (4) dan (5)
PEMBAHASAN :
(1) biokatalis atau enzim merupakan fungsi dari protein
(2) mengatur metabolisme lemak merupakan fungsi dari karbohidrat
(3) membentuk struktur sel jaringan merupakan fungsi dari karbohidrat
(4) memperbaiki sel yang rusak merupakan fungsi dari protein
(5) cadangan energi merupakan fungsi dari protein dan lemak.
Fungsi lain dari karbohidrat:
Sumber energi utama bagi tubuh
Menjaga keseimbangan asam-basa tubuh
Membantu penyerapan kalsium
Melancarkan pencernaan
Baca juga:
JAWABAN C
Soal No.18
Tabel data polimer yang berisi reaksi pembentukan, jenis polimer dan contoh
polimer
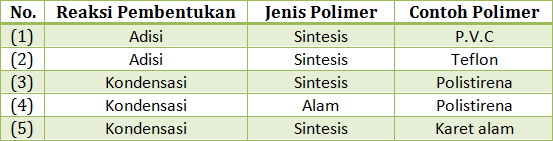
Pasangan yang berhubungan dengan tepat adalah
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (3) dan (4)
E. (4) dan (5)
- PEMBAHASAN :
P.V.C merupakan polimer sintesis yang dibentuk melalui reaksi adisi
Teflon merupakan polimer sintesis yang dibentuk melalui reaksi adisi
Polisirena merupakan polimer sintesis yang dibentuk melalui reaksi adisi
Karet alam merupakan polimer alam yang dibentuk melalui reaksi adisi
Baca juga: Bagaimana Tikus Mengubah Surga Mereka Menjadi Neraka Distopia
JAWABAN A
Soal No.19
Berikut adalah tabel nama senyawa karbon dan kegunaannya.

A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (5)
PEMBAHASAN :
Kloro etana : pembuatan tetraetil timbal yang ditambahkan ke dalam bensin
untuk memperbaiki bilangan oktan
Asam formiat : digunakan sebagai bahan koagulan untuk meng-koagulasi
karet dari lateks
Iodoform : Antiseptik
Monosodium glutamat : penyedap rasa
Glikol : Anti beku pada air radiator
JAWABAN E
Soal No.20
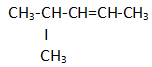
Perhatikan rumus struktur senyawa hidrokarbon berikut!
A. 2 metil, butana
B. 3 – metil, 2 – pentena
C. 2 – metil, 3 – pentena
D. metil siklo pentana
E. 2 – metil pentana
PEMBAHASAN :
JAWABAN B. yang paling mungkin adalah B. 3-Metil, 2-Pentana menurut Pak Agung dalam channel youtubenya, hal ini juga didasari dengan keisomeran fungsi
Baca juga: Mengapa Objek Langit Dominan Berbentuk Bulat
Latihan Soal UNBK USP SMA Kimia 2020 dengan Pembahasan Lengkap dan Bagus
Soal no. 21-33
Soal No.21
Suatu senyawa memiliki rumus molekul C4H8O. Jika bereaksi dengan larutan
Tollens menghasilkan endapan perak. Senyawa tersebut adalah….
A. butanal
B. butanol
C. butanon
D. 2-metil pentanal
E. 2-metil propanon
PEMBAHASAN :
C4H8O kemungkinan aldehid atau keton. Untuk membedakan aldehid dan keton
salah satunya direaksikan dengan pereaksi tollens. Aldehid akan membentuk
endapan cermin perak jika bereaksi dengan tollens sedangkan keton tidak bereaksi,
karena C nya ada 4 maka jawabannya yaitu butanal.
JAWABAN A
Soal No.22
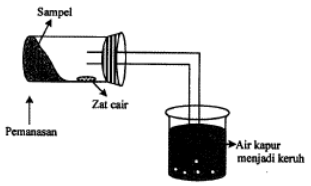
Perhatikan gambar uji senyawa karbon berikut!
Berubahnya air kapur menjadi keruh membuktikan adanya
A. hidrogen dan oksigen
B. karbon dan oksigen
C. oksigen dan nitrogen
D. Nitrogen dan Kobaltium
E. Bagaimana dengan tidak ada jawaban? HEHEHE, kamu akan tertipu.
Pembahasan:
Perubahnya air kapur menjadi keruh karena adanya Ca2 yang kemudian nanti diubah atau diturunkan menjadi Karbon dan Oksigen, jadi jawabannya adalah B.
Jawaban B.
Baca juga: Menghirup Oksigen Murni Dapat Membunuhmu
23. Berikut ini adalah tahapan-tahapan metode ilmiah:
- Menguji hipotesis
- Merumuskan masalah
- Menarik kesimpulan
- Identifikasi masalah
- Menyusun dasar teori
- Menyusun hipotesis
Urutan metode ilmiah yang benar adalah ….
- 4) – 2) – 5) – 6) – 1) – 3)
- 4) – 2) – 1) – 6) – 3) – 5)
- 4) – 1) – 5) – 2) – 6) – 3)
- 5) – 4) – 2) – 1) – 3) – 6)
- 5) – 2) – 6) – 1) – 3) – 4)
Jawaban: A
Pembahasan:
Metode ilmiah adalah langkah-langkah rasional dan ilmiah untuk mengungkapkan suatu masalah. Urutan tahapan metode ilmiah yaitu:
- Identifikasi masalah
- Merumuskan masalah
- Menyusun dasar teori
- Menyusun hipotesis
- Menguji hipotesis
- Menarik kesimpulan
Urutan yang tepat adalah 4) – 2) – 5) – 6) – 1) – 3).
24. Unsur A terletak pada golongan VIA periode 3 dan memiliki massa atom relatif sebesar 32. Jumlah proton dan neutron unsur A adalah ….
- 16 dan 16
- 16 dan 17
- 17 dan 15
- 18 dan 13
- 15 dan 17
Jawaban: A
Pembahasan:
Golongan VIA periode 3, artinya:
Elektron valensi berada pada s dan p berjumlah 6, yaitu s2 p4
Periode = jumlah kulit = 3, maka:
Konfigurasi elektron valensi : 3s2 3p4
Konfigurasi lengkap unsur A : 1s2 2s2 2p6 3s2 3p4
Untuk atom netral, Nomor atom = nomor elektron = 2 + 2 + 6 + 2 + 4 = 16
Nomor atom = nomor proton = 16
Nomor neutron = nomor massa – nomor proton
= 32 – 16
= 16
25. Dibanding asam halida yang lain, senyawa HF memiliki titik didih yang paling tinggi. Hal ini disebabkan karena pada senyawa HF terdapat ….
- Ikatan kovalen
- Ikatan hidrogen
- Ikatan elektrovalen
- Ikatan ionik
- Ikatan logam
Baca juga:
- Latihan Soal USBN USP PKN SMA/SMK 2020
Jawaban: B
Pembahasan:
Senyawa HF memiliki titik didih paling tinggi dibandingkan senyawa halida (HX) lainnya, hal ini disebabkan pada senyawa HF terdapat ikatan hidrogen. Ikatan hidrogen bersifat sangat kuat, sehingga dibutuhkan energi yang lebih besar untuk memtusukan ikatan hidrogen.
Ikatan hidrogen adalah ikatan antarmolekul yang terjadi antara atom H dan atom dengan elektronegatifitas tinggi seperti F, O, dan N.
Baca juga: 9 Virus Mematikan dalam Sejarah Manusia
26. Sebanyak 5 gram CaCO3 direaksikan dengan 100 mL HCl 0,5 M menurut reaksi berikut:
CaCO3 (s) + HCl (aq) -> CaCl2 (aq) + H2O (g) + CO2 (g) (reaksi belum setara)
Volume CO2 yang terbentuk jika diukur pada suhu kamar sebanyak ….
- 0,2 L
- 0,4 L
- 0,6 L
- 0,8 L
- 1,0 L
Jawaban: C
Pembahasan:
Setarakan reaksi terlebih dahulu:
CaCO3 (s) + 2HCl (aq) -> CaCl2 (aq) + H2O (g) + CO2 (g)
Tentukan pereaksi pembatas.
Mol CaCO3 = 
Mol HCl = M x V = 0,5 M x 100 mL = 50 mmol = 0,05 mol
Sehingga, yang menjadi pereaksi pembatas adalah HCl. Pereaksi pembatas adalah zat yang memiliki ![]() paling kecil.
paling kecil.
Persamaan reaksi:
CaCO3 (s) + 2HCl (aq) -> CaCl2 (aq) + H2O (g) + CO2 (g)
Mula – mula 0,05 0,05 – –
Reaksi 0,025 0,05 0,025 0,025 0,025
Sisa 0,025 – 0,025 0,025 0,025
Ingat! Perbandingan mol = perbandingan koefisien.
Mol CO2 = 0,025 mol.
Pada keadaan suhu kamar atau RTP (Room temperature Preasure) berlaku:

27. Perhatikan reaksi berikut ini!
- HF + H2O -> F– + H3O+
- NH3+ H2O -> NH4+ + OH–
- C6H5COOH + H2O -> C6H5COO– + H3O+
- RNH2+ H2O -> RNH3 + OH–
Air merupakan salah satu zat yang bersifat amfoter, artinya dapat bertindak sebagai asam maupun basa. Reaksi yang menunjukkan air bertindak sebagai basa adalah ….
- 1, 2, dan 3
- 1 dan 3
- 2 dan 4
- 4 saja
- 1, 2, 3, 4
Jawaban: B
Baca juga: Bagaimana Cara Bulan Terbentuk
Pembahasan:
Asam Basa Bronsetd-Lowry adalah pasangan asam basa yang hanya berbeda pada satu atom H saja. Asam memiliki atom H lebih banyak dibandingkan basa.
Pada reaksi (1) HF + H2O -> F– + H3O+
H2O berpasangan dengan H3O+, H2O memiliki atom H 1 lebih sedikit dibandingkan H3O+ sehingga H2O pada reaksi ini bertindak sebagai basa.
Pada reaksi (3) C6H5COOH + H2O -> C6H5COO– + H3O+
H2O berpasangan dengan H3O+, H2O memiliki atom H 1 lebih sedikit dibandingkan H3O+ sehingga H2O pada reaksi ini bertindak sebagai basa.
28. Seorang siswa mengencerkan sebanyak 5 mL H2SO4 pekat hingga volume nya mencapai 500 mL. Kemudian 25 mL larutan hasil pengenceran tersebut tepat dinetralkan dengan 50 mL NaOH 0,15 M. Konsentrasi asam pekat tersebut adalah ….
- 7,5 M
- 12,5 M
- 15 M
- 17 M
- 18 M
Jawaban: C
Pembahasan:
Gunakan rumus titrasi untuk mengetahui konsentrasi H2SO4 hasil pengenceran:
Ma . Va . a = Mb . Vb . b
Ma . 25 mL . 2 = 0,15 M . 50 mL . 1
Ma = 0,15 M
Gunakan rumus pengenceran untuk mengetahui konsentrasi H2SO4 pekat:
M1 . V1 = M2 . V2
M1 . 5 mL = 0,15 M . 500 mL
M1 = 15 M
29. Larutan penyangga adalah larutan yang dapat mempertahankan pH. Di dalam darah manusia terdapat sistem penyangga yang dapat menjaga pH darah selalu stabil, sistem penyangga tersebut adalah ….
- H3PO4dan H2PO4–
- HCO3–dan CO32-
- HPO42-dan H2PO4–
- H2CO3dan HCO3–
- HPO42-dan PO42-
Jawaban: D
Pembahasan:
Sistem penyangga dalam darah berfungsi untuk menjaga pH darah agar selalu stabil. Sistem penyangga yang terdapat dalam darah adalah H2CO3 dan HCO3–.
Sedangkan, HPO42- dan H2PO4– merupakan sistem penyangga dalam cairan sel tubuh.
30. Seorang siswa memiliki beberapa jenis garam yang berbeda. Garam – garam tersebut dilarutkan dalam air kemudian diuji menggunakan indikator kertas lakmus. Garam yang dapat mengubah warna lakmus merah menjadi biru adalah ….
- amonium klorida
- barium nitrat
- natrium asetat
- kalium sulfat
- kalium bromida
Jawaban: C
Pembahasan:
Garam jika dilarutkan dalam air maka akan mengalami reaksi hidrolisis. Reaksi hidrolisis garam terbagi menjadi:
- Hidrolisis sebagian — merupakan garam yang berasal dari asam lemah dengan basa kuat (garam basa) dan garam yang berasal dari asam kuat dan basa lemah (garam asam)
- Hidrolisis sempurna — merupakan garam yang berasal dari asam dan basa lemah
- Tidak terhidrolisis — merupakan garam yang berasal dari asam dan basa kuat
Garam yang dapat mengubah warna lakmus merah menjadi biru adalah garam yang bersifat basa, yaitu garam yang berasal dari asam lemah dan basa kuat atau garam yang berasal dari asam lemah dan basa kuat dengan nilai Kb > Ka.
- amonium klorida — berasal dari amonium hidroksida (basa lemah) dan asam klorida (asam kuat) — garam asam
- barium nitrat — berasal dari barium hidroksida (basa kuat) dan asam nitrat (asam kuat) — garam netral
- natrium asetat — berasal dari natrium hidroksida (basa kuat) dan asam asetat (asam lemah) — garam basa
- kalium sulfat — berasal dari kalium hidroksida (basa kuat) dan asam sulfat (asam kuat) — garam netral
- kalium bromida — berasal dari kalium hidroksida (basa kuat) dan asam bromida (asam kuat) — garam netral
31. Reaksi pembentukan gas NH3 memiliki persamaan sebagai berikut:
N2 (g) + 3H2 (g) -> 2NH3 (g) ![]()
Pernyataan berikut yang tepat adalah ….
- Entalpi reaksi pembentukan standar NH3 = -2a kJ
- Reaksi pembentukan NH3 merupakan reaksi endoterm.
- Reaksi pembentukan standar NH3 akan melepaskan kalor sebanyak a kJ
- Pada pembentukan 1 mol NH3 dibutuhkan kalor sebanyak 2a kJ.
- Pada reaksi pembentukan standar NH3 sebanyak a kJ kalor mengalir dari lingkungan ke sistem
Jawaban: C
Pembahasan:
Reaksi tersebut merupakan reaksi eksoterm, karena entalpi bertanda negatif.
Pada reaksi eksoterm terjadi perpindahan kalor dari sistem ke lingkungan karena kalor dilepas dari sistem.
Pembentukan 1 mol NH3 akan melepaskan kalor sebanyak a kJ.
Ingat! Entalpi standar merupakan entalpi untuk pembentukan 1 mol senyawa.
32. Seorang siswa melakukan percobaan kinetika kimia dengan mereaksikan sejumlah zat. Variabel bebas dari reaksi tersebut adalah konsentrasi zat dan variabel terikat adalah laju reaksi. Setelah akhir percobaan ternyata laju reaksi meningkat pada konsentrasi yang lebih tinggi, fenomena ini dapat dijelaskan karena kenaikan konsentrasi akan ….
- memperbesar suhu reaksi
- memperbesar energi aktivasi
- memperbesar tekanan
- memperbesar energi kinetik molekul reaktan
- meningkatan frekuensi tumbukan efektif
Jawaban: E
Pembahasan:
Salah satu faktor yang mempengaruhi laju reaksi adalah konsentrasi. Makin tinggi konsentrasi, frekuensi terjadinya tumbukan akan makin banyak terjadi sehingga laju reaksi semakin besar.
Soal Nomor 33.
Perhatikan gambar model atom berikut!
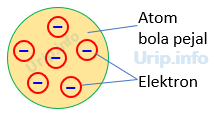
Berikut beberapa pernyataan mengenai model atom:
1. tidak dapat menjelaskan susunan muatan positif dan negatif yang tersebar merata di
seluruh bagian atom
2. atom merupakan bola pejal yang bermuatan positif dan di dalamnya tersebar elektron
yang bermuatan negatif
3. tidak dapat menerangkan kejadian-kejadian dalam ikatan kimia dengan baik,
pengaruh medan magnet terhadap atom-atom, dan spektrum atom yang berelektron
lebih banyak
4. atom merupakan partikel yang bersifat netral
Pasangan pernyataan yang tepat mengenai gambar model atom tersebut adalah ……
A. (1) dan (2)
B. (1) dan (3)
C. (1) dan (4)
D. (2) dan (4)
E. (3) dan (4)
Pembahasan Soal Nomor 1.
Gambar pada soal ini mencirikan model atom Thomson.
Pernyataan yang tepat dengan model atom Thomson adalah (2) dan (4)
Jawaban yang tepat D.
Sumber:
- Blog Ruangguru. https://blog.ruangguru.com/
- Zenius UTBK Kimia. https://www.zenius.net/blog/6219/belajar-utbk-kimia

